Il
principio di funzionamento
Una cella a combustibile produce energia
elettrica a partire da idrogeno ed ossigeno (o aria)
senza organi in movimento.
Essa converte direttamente per via
elettrochimica l'energia libera del combustibile, presentando perciò alti
rendimenti, con una assenza quasi totale di emissioni.
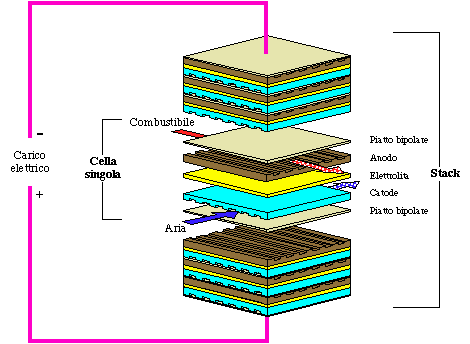
E' costituita da un anodo a cui viene inviato l'idrogeno ed un catodo cui
viene inviata l'aria con interposizione di un elettrolita conduttore di ioni.
Le due semi reazioni che avvengono agli
elettrodi sono:
anodo H2 = 2H+ + 2e
catodo ½ O2 +
2H+ + 2e = H2O
La reazione totale è quindi H2
+ ½ O2 = H2O che corrisponde alla
reazione di formazione dell'acqua; la variazione di energia libera associata a
questa reazione genera un potenziale di Nerst cioè un
potenziale elettrico:
D G° = -nFE
Dove:
D G° è la variazione di energia libera associata alla
reazione = 228,61 kJ/mole;
n è il numero di moli di elettroni coinvolti nella reazione
= 2;
F è la carica elettrica posseduta da una mole
di elettroni = 96.488 Coulomb;
E è il potenziale di Nerst.
Esplicitando l'espressione si ricava il valore
del potenziale:
E = - D G°/nF
E = - 228,61/(2x96488) =1,18 V
Ne segue che durante l'ossidazione di una mole
di elettroni di idrogeno si instaura una differenza di potenziale tra anodo e
catodo pari a circa 1,2 V.
Se gli elettroni coinvolti nella reazione
vengono fatti passare in un conduttore metallico esterno al circuito si otterrà
una energia elettrica utilizzabile; all'interno dell'elettrolitica si
muoveranno invece gli ioni così da completare la reazione.
![]()
I vari tipi di celle a combustibile prendono
il nome dal tipo di elettrolita utilizzato: nel nostro caso esso è costituito
da una membrana polimerica tipo "Nafion" da
cui il nome di celle a combustibile ad elettrolita polimerico (SPEFC) o a
membrana.
Uno stack è
costituito da un certo numero di celle elementari (anodo, elettrolita, catodo)
impilate una sull'altra e collegate elettricamente in serie in modo da ottenere
ai capi della "pila" un valore significativo di tensione essendo la
tensione cella singola pari a 0.5-0.7 Volt.