Termodinamica delle celle a combustibile ad elettrolita polimerico
2.1 Introduzione
Come noto l'energia chimica posseduta da un combustibile non è convertita direttamente in lavoro meccanico, sono generalmente necessari dei passaggi intermedi in cui l'energia stessa è trasformata in calore.
Questo calore viene quindi somministrato ad un fluido motore che compie un ciclo termodinamico fornendo infine del lavoro meccanico.
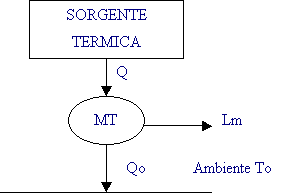
Fig. 1.2 – Schema a blocchi
di una macchina termica
Qualunque ciclo termodinamico è soggetto all'effetto Carnot che tramite le temperature delle sorgenti ne limita fortemente il rendimento.
![]()
In altri termini l'energia pregiata posseduta dal combustibile viene fortemente degradata prima di essere trasformata in lavoro utile, quindi solo una frazione della stessa è disponibile per compiere il lavoro richiesto:
![]()
Ad esempio nel caso della combustione adiabatica del metano con eccesso d'aria del 20 % l’exergia[1] dei reagenti è pari a 752.4 kJ/mol mentre la miscela dei prodotti di combustione ha una temperatura di 2150 K e un exergia di 532.385 kJ/mol si è quindi perso il 29,4 % del lavoro disponibile in partenza semplicemente nel processo di combustione.
Considerando poi le condizioni reali, il ciclo termodinamico che devono compiere i gas e la dissociazione dei reagenti durante la reazione, la situazione diventa ben più grave.
Nel caso delle celle a combustibile l'ossidoriduzione dell'idrogeno fornisce una entalpia di 241,84 kJ/mole ed un energia libera di 227,968 kJ/mole. Quest’ultima è praticamente equivalente all’exergia e viene quindi direttamente convertita in un lavoro utile sotto forma di una differenza di potenziale, che notoriamente rappresenta un’energia "ordinata"; il lavoro massimo disponibile è quindi di 227.968 kJ/mol con una perdita solo del 5,9 %.
2.2 Termodinamica reversibile
In base al primo principio della termodinamica è possibile calcolare il lavoro e l'energia scambiata nella reazione
![]()
![]()
![]()
![]()
![]()
Dove:
E è la differenza di potenziale tra gli elettrodi
q è la carica trasportata
n è il numero di moli di elettroni trasportati durante la reazione
F è la costante di Faraday che indica la carica trasportata da una mole di elettroni.
![]()
![]()
![]()
![]()
Essendo la reazione isobara l'equazione si semplifica
![]()
![]() Energia
disponibile dalla reazione
Energia
disponibile dalla reazione
![]()
![]()
![]() Energia libera (1.2)
Energia libera (1.2)
![]() Calore ceduto
all'ambiente, calore perso
Calore ceduto
all'ambiente, calore perso
Possiamo a questo punto indicare il rendimento termodinamico ideale:
![]() (2.2)
(2.2)
Per la reazione![]()
![]()
|
Specie chimica |
|
|
|
|
|
-241,84 |
-228,61 |
188,74 |
|
|
-285,85 |
-237,19 |
69,96 |
|
|
0 |
|
205,02 |
|
|
0 |
|
130,58 |
Tab. 1.2 - Entalpia,
energia libera ed entropia per le specie della reazione
![]() Con gas a
fine reazione
Con gas a
fine reazione
![]() Con
liquido a fine reazione
Con
liquido a fine reazione
Dovendo tenere conto dell'influenza della temperatura sui calori specifici, indichiamo gli stessi approssimando il calcolo al quadrato della temperatura
![]() con a, b, c valori
tabulati
con a, b, c valori
tabulati
Consideriamo l'equazione di Kirchoff
![]() (3.2)
(3.2)
![]() Indica l'aumento
totale della capacità termica risultante
Indica l'aumento
totale della capacità termica risultante
![]() Indicano la differenza tra i valori
relativi ai prodotti e ai reagenti
Indicano la differenza tra i valori
relativi ai prodotti e ai reagenti
|
Sostanza |
a |
b |
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tab. 2.2 - Costanti
sperimentali valide nel campo di temperature 273-1500K
espresse in cal/mole K
Nel nostro caso:
![]() ,
, ![]()
![]() ,
, ![]()
![]() ,
, ![]()
Integrando la 3.2 tra la temperatura di funzionamento della cella (343 K) ed la temperatura standard
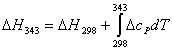
![]()
![]() con gas a
fine reazione
con gas a
fine reazione
![]() con
liquido a fine reazione
con
liquido a fine reazione
Calcoliamo l'entropia di
reazione standard ![]() per prodotti gassosi
per prodotti gassosi
![]()
![]()
![]() per prodotti gassosi
per prodotti gassosi
![]() per prodotti liquidi
per prodotti liquidi
Valutiamo adesso l'influenza della temperatura sulla variabile entropia.
![]()
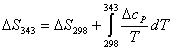
![]()
![]() con
gas a fine reazione
con
gas a fine reazione
![]() con
liquido a fine reazione
con
liquido a fine reazione
Calcolo quindi il rendimento della cella operante a 70° C e 1 atm.
![]()
![]() con gas a fine
reazione
con gas a fine
reazione
![]() con liquido a fine
reazione
con liquido a fine
reazione
![]() Con gas a fine
reazione
Con gas a fine
reazione
![]() 0,802 Con
liquido a fine reazione
0,802 Con
liquido a fine reazione
Possiamo notare che l’influenza della temperatura sul rendimento è di pochi percento, il calcolo poteva essere svolto considerando i calori specifici costanti senza commettere errori significativi, mentre lo stato dei prodotti di reazione influenza significativamente il rendimento termodinamico.
Determinazione del potenziale della cella
Riprendendo la 1.2 possiamo calcolare la fem standard presente tra gli elettrodi della cella.
![]()
![]()
nel caso specifico
![]()
![]() quindi
n = 2
quindi
n = 2
![]() per
prodotti gassosi e a 298K
per
prodotti gassosi e a 298K
![]() per
prodotti gassosi e a 343K
per
prodotti gassosi e a 343K
![]() per
prodotti liquidi a 298K
per
prodotti liquidi a 298K
![]() per
prodotti liquidi a 343K
per
prodotti liquidi a 343K
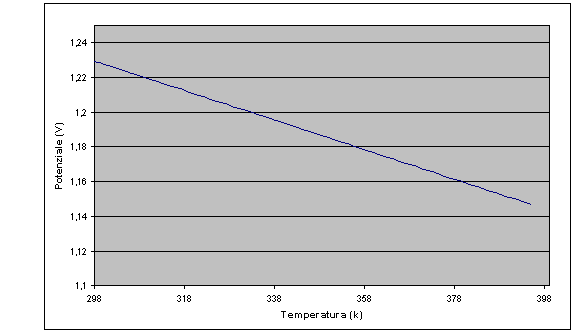
Fig. 2.2 – Variazione del potenziale con la
temperatura
Considerando l'equazione delle masse per la nostra reazione possiamo tramite l'equazione di Nerst calcolare la variazione del potenziale della cella al variare della pressione
Per il generico equilibrio
![]()
Indicando con ![]() le energie libere
molari standard delle specie A, B, C e D e ricordando che la variazione di
energia libera di una mole di gas, che a temperatura costante passa da pressione
le energie libere
molari standard delle specie A, B, C e D e ricordando che la variazione di
energia libera di una mole di gas, che a temperatura costante passa da pressione![]() a pressione
a pressione![]() , è
, è 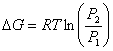 .
.
Possiamo così scrivere per ogni elemento
![]()
e, per l'intera reazione
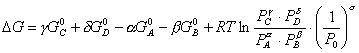
con ![]()
mentre
all'equilibrio ![]()
quindi ![]()
dove ![]() è la costante termodinamica di equilibrio della reazione.
è la costante termodinamica di equilibrio della reazione.
In definitiva l'energia libera della reazione può essere espressa dalla seguente espressione:
![]() con Q
quoziente di reazione (4.2)
con Q
quoziente di reazione (4.2)
La reazione si svolgerà spontaneamente sino al
raggiungimento dell'equilibrio ![]()
Sostituendo la 4.2 nella 1.2 otteniamo l'equazione di Nerst
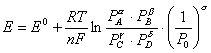
![]()
le pressioni sono espresse in atmosfere
Nel nostro caso:
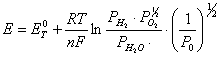
![]() per
prodotti gassosi
per
prodotti gassosi
![]() per
prodotti gassosi
per
prodotti gassosi
![]() per
prodotti liquidi
per
prodotti liquidi
![]() per
prodotti liquidi
per
prodotti liquidi
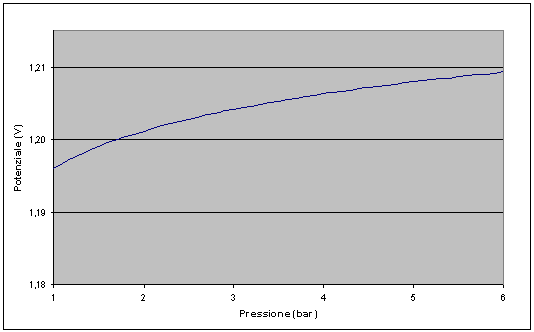
Fig. 3.2 – Variazione del potenziale con la pressione
(T=343K)
2.3 Termodinamica irreversibile
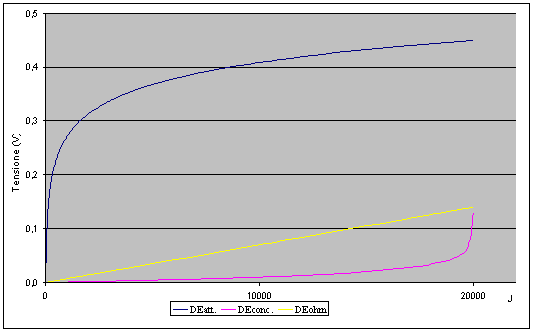
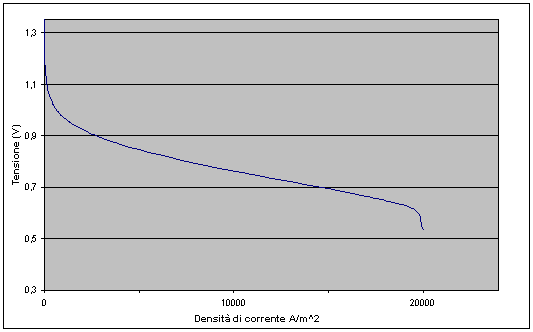
La potenza elettrica erogata dalla cella è chiaramente il prodotto della differenza di potenziale agli elettrodi per la corrente che attraversa il circuito, tuttavia nel momento in cui il circuito viene chiuso e ed il flusso di ioni idrogeno comincia ad attraversare la cella si manifestano dei fenomeni irreversibili che provocano una diminuzione del potenziale elettrico, tali fenomeni prendono il nome di polarizzazioni o sovratensioni e sono generalmente di tre tipi:
Polarizzazione Ohmica. Le perdite sono dovute alla resistenza della membrana elettrolitica al flusso degli ioni e alla resistenza elettrica e di contatto degli elettrodi. Queste perdite si possono ridurre diminuendo lo spessore della membrana ed aumentandone l’efficacia, avvicinando gli elettrodi e favorendone un intimo contatto con l’elettrolita.
Dato che entrambi i fenomeni sopracitati rispettano la legge di Ohm, possiamo quantificarli tramite la seguente equazione:
![]()
Dove:
R, i cui valori attuali
sono di circa 0,07 ![]() ,è appunto la resistenza totale della cella ed è funzione di
diversi parametri:
,è appunto la resistenza totale della cella ed è funzione di
diversi parametri:
- la resistenza ionica della membrana;
- la resistenza elettronica degli elettrodi;
- la resistenza al trasferimento di carica degli elettrodi.
I è la corrente che la attraversa la membrana stessa.
Polarizzazione di Concentrazione: E’ dovuta al fatto che in prossimità di un elettrodo esiste un gradiente di concentrazione poiché il reagente viene rapidamente consumato dalla reazione. Le cause di questo fenomeno sono legate all’insufficiente porosità dell’elettrodo che non permette un’efficace diffusione del gas, ed infine alla diffusione attraverso l’elettrolita stesso dei reagenti e dei prodotti da e verso i rispettivi luoghi di reazione.
Possiamo quantificare la caduta di potenziale tramite la legge di Fick:
![]()
Dove:
J
è la densità di corrente (![]() )
)
D è il coefficiente di diffusione per le specie reagenti (kg / h m)
![]() è la concentrazione
del gas nello strato si adsorbimento
è la concentrazione
del gas nello strato si adsorbimento
![]() è la concentrazione
effettiva del gas di alimentazione sulla superficie dell’elettrodo
è la concentrazione
effettiva del gas di alimentazione sulla superficie dell’elettrodo
![]() è lo spessore dello strato di diffusione
è lo spessore dello strato di diffusione
![]() è il peso molecolare della specie che diffonde
è il peso molecolare della specie che diffonde
Nel caso limite in cui la
concentrazione del reagente all’elettrodo sia pari a quella disponibile (![]() ), la densità di corrente assume il valore massimo
), la densità di corrente assume il valore massimo
![]()
Sostituendo otteniamo:
![]()
Esprimendo l’equazione di Nerst tramite la concentrazione del reagente a circuito aperto:
![]()
mentre quando nello stesso circola corrente:
![]()
La differenza del potenziale nei due casi rappresenta la caduta di tensione del circuito
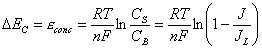
Polarizzazione di attivazione: E’ causata dal doppio strato elettrico che si instaura sulla superficie dell’elettrodo, determina un impedimento nel trasferimento di carica tra l’elettrodo stesso e l’elettrolita diminuendo la velocità della cinetica chimica.
Tutto questo si esplica in una tensione di attivazione che le specie reagenti devono superare per dar luogo alla reazione.
Tramite la relazione di Talef è possibile quantificare la caduta di tensione provocata dal fenomeno.
![]()
Dove:
![]()
![]()
![]() Coefficiente di
trasferimento (0,5).
Coefficiente di
trasferimento (0,5).
![]() Densità della
corrente di scambio relativa all’equilibrio (per Pt come catalizzatore vale circa 10
Densità della
corrente di scambio relativa all’equilibrio (per Pt come catalizzatore vale circa 10 ![]() ).
).
2.4 Polarizzazione degli elettrodi
Le polarizzazioni di attivazione e di concentrazione sono presenti su entrambi gli elettrodi; esprimendo le cadute di potenziale sia al catodo che all’anodo si ottiene:
![]()
![]()
Possiamo così indicare il potenziale agli elettrodi:
![]()
![]()
notiamo che si ha un aumento del potenziale all’anodo e una diminuzione al catodo.
Il risultato complessivo delle polarizzazioni è quindi una diminuzione della tensione agli elettrodi della cella:
![]()
Ovvero:
![]()
Il grafico che segue rappresenta le perdite presenti nella cella. E’ interessante osservare che le perdite per attivazione sono quelle preponderanti in questo tipo di Fuel Cell; la tecnologia impiegata nella preparazione del catalizzatore ovvero dell’intero elettrodo ricopre quindi una importanza strategica.
2.5 Rendimento
Il rendimento complessivo della cella può essere espresso come il prodotto dei rendimenti dei diversi fenomeni dissipativi che avvengono durante l’ossidoriduzione dell’idrogeno.
Il rendimento termodinamico, è già stato definito:
![]()
La polarizzazione sarà responsabile del rendimento in tensione, indicata dal rapporto tra la tensione di cella ed il potenziale reversibile.
![]()